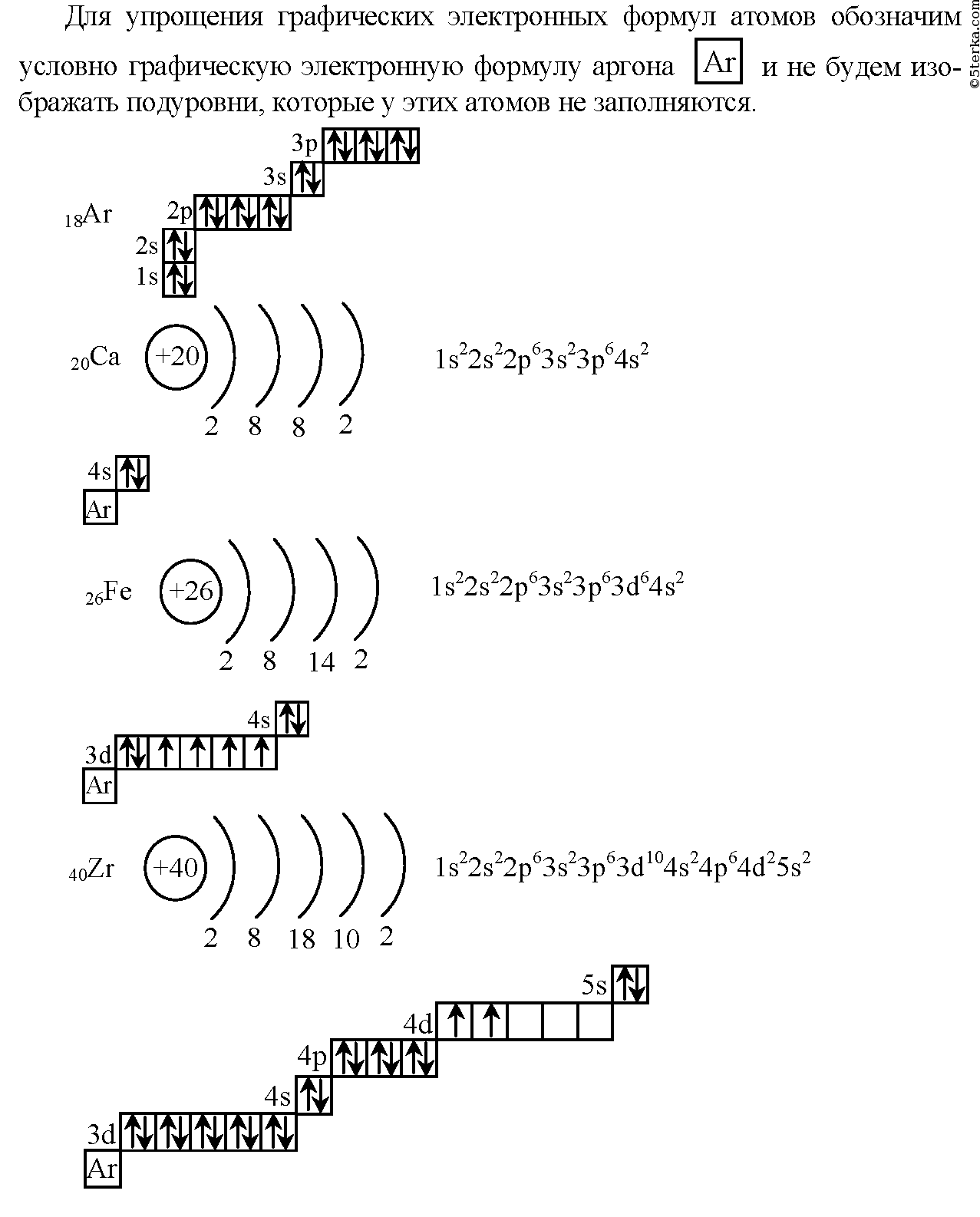
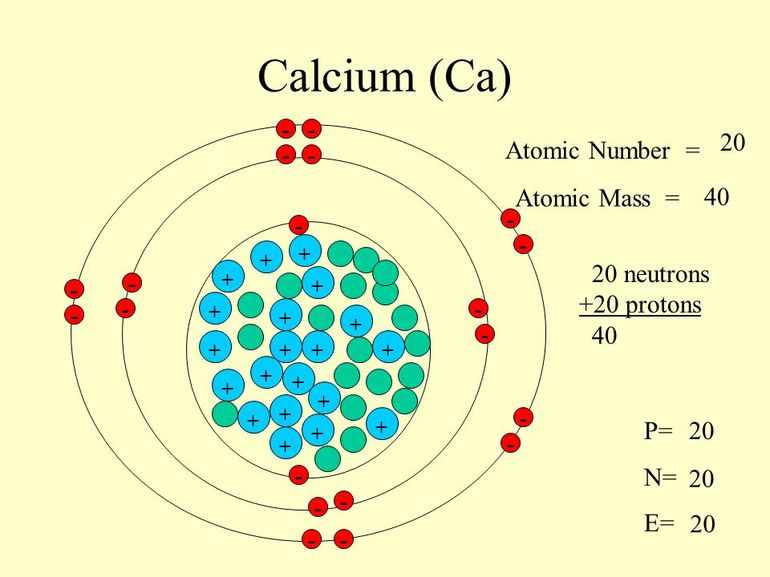
Строение атома кальция
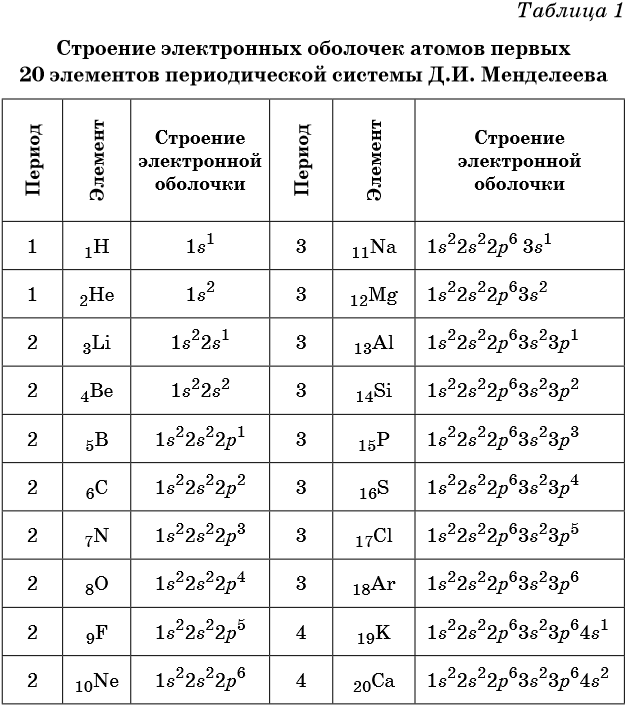
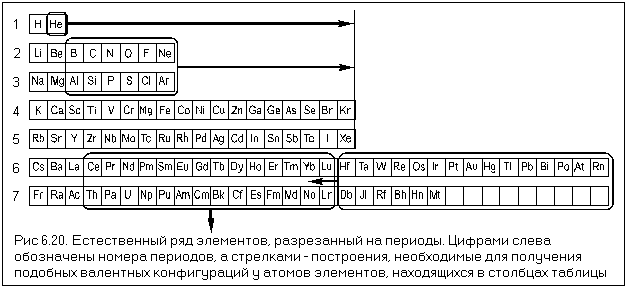
Между положением элемента в периодической системе элементов и распределением электронов в его атоме по энергетическим уровням наблюдается определенная связь. Ёмкость первого энергетического уровня на этом исчерпана, поэтому следующий электрон оказывается на втором энергетическом уровне - в Периодической системе открывается второй период. На втором энергетическом уровне может находиться не больше восьми электронов, поэтому в данном периоде не может быть больше восьми элементов. Далее следует третий период. Тем не менее период завершается. Некоторые особенности появляются при формировании электрон-ных оболочек в атомах элементов шестого периода.

Удобная навигация, видео-разборы тем, задачи для самопроверки — всё это в вашем кармане. А ещё раздел с полезными материалами, календарь занятий и уведомления о предстоящих уроках. В химических реакциях ядра атомов не изменяются. Было установлено, что все химические свойства веществ определяются строением электронных оболочек атомов.


| Содержание | 219 | Электронная структура атома кальция Ca I содержит 20 электронов, которые полностью заполнили 8 оболочек. |
| § 10. Периодический закон в свете теории строения атома | 352 | Модель вещества атома в настоящее время разработана в деталях и понятна настолько, что колоссальную энергию, заключенную в нем, научились извлекать и поставили на службу человеку в первую вчередь это АЭС. Тем не менее хотелось бы убедиться в правильности наших представлений об атоме, увидеть изображение реального атома, «пощупать» руками, прогнозировать дальнейший прогресс исследований вещества. |
| Последние публикации в коллективном блоге: | 216 | Атом можно представить как конструктор «Лего», который можно собрать из более простых элементарных частиц. |
| Основное меню | 259 | В IA группу входят литий, натрий, калий, рубидий и цезий. |
| 463 | Свойства каждого химического вещества делятся на два типа: это химические, которые характеризуют его способность образовывать другие вещества, и физические, которые объективно наблюдаются и могут быть рассмотрены в отрыве от химических превращений. Так, например, физическими свойствами вещества являются его агрегатное состояние твердое, жидкое или газообразное , теплопроводность, теплоемкость, растворимость в различных средах вода, спирт и др. | |
| 329 | Кальций Ca — щелочноземельный металл, входящий в состав минералов. | |
| 101 | Ca lcium — химический элемент 2-й группы по устаревшей классификации — главной подгруппы второй группы, IIA четвёртого периода периодической системы химических элементов Д. Менделеева с атомным номером | |
| 468 | Окружающие нас тела состоят из мельчайших частиц — атомов. Интересно узнать, какова же структура этих «кирпичиков» Мироздания? | |
| 432 | Согласно схеме распределения атомных орбиталей по энергии, изображённой на рисунке 18 , энергия 3 d -орбиталей выше, чем 4 s -орбиталей , поэтому в атоме калия последний электрон занимает более низкую по энергии 4 s -орбиталь с образованием электронной конфигурации 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 1. Аналогично происходит и с последними двумя электронами атома кальция. |
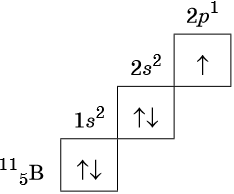
Кальций имеет 20 электронов, заполним электронные оболочки в описанном выше порядке:. Атомы кальция в соединениях имеют степени окисления 2. Степень окисления - это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается заряд, то степень окисления отрицательная электроны несут отрицательный заряд , если заряд уменьшается, то степень окисления положительная. Атомы кальция в соединениях проявляют валентность II.


